Nueva estrategia para identificar variantes de Rubisco más eficientes en la fijación de carbono
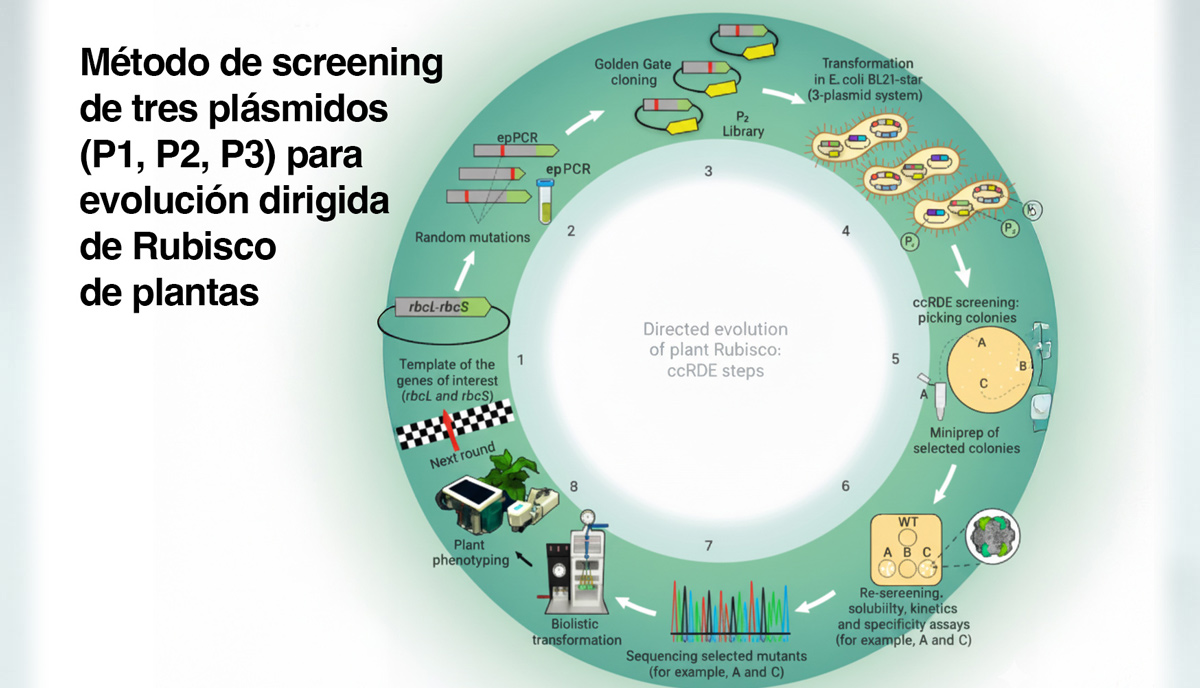
Una forma realmente interesante de seguir explorando y trabajando en pos de una Rubisco más eficiente: La Rubisco, considerada la proteína más abundante de la Tierra, es una enzima que fija el CO₂ en azúcares durante la fotosíntesis. La fijación de carbono es el proceso mediante el cual el CO₂ se convierte en biomasa en el ciclo de Calvin. La enzima ribulosa-1,5-bisfosfato carboxilasa/oxigenasa (Rubisco), fija una molécula de CO₂ por vuelta del ciclo en azúcares biodisponibles.
A pesar de ser crucial para la asimilación del carbono, la Rubisco es ineficiente. A veces confunde el O₂ con el CO₂ y desperdicia energía. Las plantas compensan esto con su concentración bruta y, de hecho, hasta la mitad de la proteína soluble en las plantas es Rubisco.
Se ha intentado diseñar mejores Rubiscos durante décadas, pero no es fácil porque las proteínas son grandes, están compuestas por 16 subunidades, y no se pliegan fácilmente (necesitan proteínas chaperonas para su correcto funcionamiento).
Un grupo de investigadores en Australia desarrollo una técnica para expresar las Rubiscos vegetales (y sus siete chaperonas de plegamiento) utilizando un conjunto de tres plásmidos dentro de células de Escherichia coli. De esa forma, lograron realizar una "evolución dirigida" de la Rubisco en células bacterianas y encontrar mutantes de la Rubisco con mayor eficiencia enzimática o que se pliegan mejor.
Además de los tres plásmidos, los investigadores también indujeron a la E. coli a producir ribulosa-1,5-bifosfato (RuBP), que es el azúcar de 5 carbonos que la Rubisco combina con dióxido de carbono para producir moléculas de 3-fosfoglicerato (3-PGA).
Lo ingenioso es que se mutan aleatoriamente los tres plásmidos que codifican la Rubisco para generar millones de variantes. Luego, se introducen esos plásmidos mutados en E. coli. Si la E. coli no produce una Rubisco funcional, los niveles de RuBP se acumulan y matan la célula; la molécula se vuelve tóxica. Pero si la E. coli sí produce una Rubisco funcional, mantiene los niveles de RuBP bajo control y sobrevive sin problemas.
Mediante este ensayo de screening, los investigadores encontraron 46 colonias de E. coli de rápido crecimiento. Dos de esas colonias codificaron mutaciones muy útiles. Una mutación (M116L) hace que la Rubisco sea entre un 25 % y un 40 % más rápida. La otra (A242V) hace que su plegado y ensamblaje sea mucho más eficiente.
Introdujeron estas mutaciones en plantas de tabaco y midieron el crecimiento. Las plantas de tabaco transformado con Rubisco híbrido de Arabidopsis con la mutación M116L crecieron un 75 % más rápido, en determinadas situaciones, que las de tenían la enzima híbrida no mutada, y la sustitución A242V aumentó tanto la producción de Rubisco híbrido como el crecimiento vegetal en aproximadamente un 50 %, con respecto a la enzima híbrida no mutada.
No se garantiza que estas mutaciones, con el potencial de mejorar el crecimiento de las plantas, se puedan aplicar a otros cultivos, sin embargo, es un muy buen método para un prototipado más rápido.
Sin duda un avance que contribuye al conocimiento y mejoramiento de la eficiencia de la fijación de carbono.
Fuente: Nature Plants volume 11, pages1939–1950 (2025)


